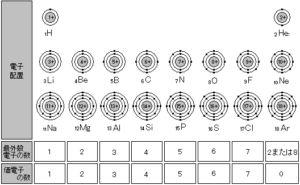
イオン
イオン化エネルギー
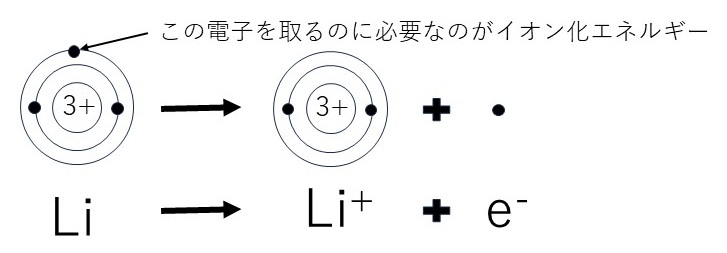
原子が最外殻電子を1個放出し、1価の陽イオンになるときに必要なエネルギーを、特に第一イオン化エネルギーという。第一イオン化エネルギーが小さいほど、陽イオンになりやすい(陽性が強いという)。
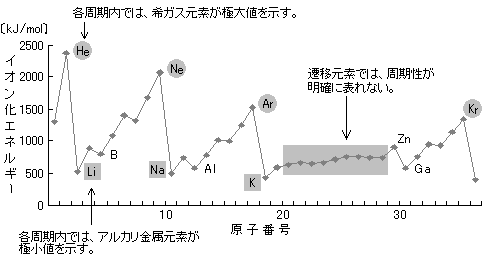
同一周期でイオン化エネルギーの大小を比較すると、原子番号が大きくなるほど(周期表で右にいくほど)大きくなる。
同一の族でイオン化エネルギーの大小を比較すると、原子番号が小さくなるほど(周期表で上にいくほど)大きくなる。
電子親和力
原子が最外電子殻に電子1個を受け取り、1価の陰イオンになるときに放出されるエネルギーを電子親和力という。
電子親和力が大きいほど陰イオンになりやすい(陰性が強いという)。電子親和力は17族元素が最も大きく(Clが最大)、ついで16族元素が大きい。
【注意】希ガス元素は最外殻が閉殻なので電子を受け取ることができない。そのため、希ガス元素の電子親和力は定義されていない。